A. Pengenalan Senyawa Hidrokarbon
Pada
awalnya, para ahli kimia menggolongkan senyawa atas senyawa organik dan
senayawa anorganik. Penggolangan ini dilakukan berdasarkan sumber
senyawa-senyawa tersebut. Senyawa organik berasal dari makhluk hidup, sedangkan
senyawa anorganik berasal dari alam diluar makhluk hidup. Contoh senyawa organik
adalah karbohidrat yang dihasilkan oleh tumbuhan melalui fotosintesis, urea
yang terdapat dalam urine mamalia, dan vitamin C yang terdapat pada
buah-buahan.
Dari percobaan wohler ini, senyawa organik urea dapat
dibuat dilaboratorium.
Pendapat yang menyatakan bahwa senyawa organik
berasal dari makhluk hidup dapat dipatahkan. (Aas Saidah dan Michael Purba, 2014 : 3)
Perbedaan
|
Senyawa organik
|
Senyawa anorganik
|
Stabilitas terhadap pemanasan
|
Kurang stabil
|
Stabil
|
Titik cair dan titik didih
|
Umumnya relatif rendah
|
Umumnya sangat tinggi, tetapi ada
yang sangat rendah
|
Kelarutan
|
larut dalam pelarut non polar
|
Larut dalam pelarut polar (air)
|
Kereaktifan
|
Bereaksi dengan lambat, kecuali
pembakaran
|
Bereaksi dengan cepat
|
Struktur
|
Umumnya terdiri dari rantai karbon
yang berikatan kovalen (senyawa karbon)
|
Umumnya terdiri dari ikatan ion atom
bukan rantai karbon
|
1. Mengidentifikasi Senyawa Karbon
Adanya unsur karbon dan
hidrogen dalam sampel organik secara lebih pasti dapat ditunjukkan melalui
percobaan sederhana yaitu dengan uji pembakaran. Pembakaran sampel organik akan
akan mengubah karbon (C) menjadi karbon dioksida (CO2) dan hidrogen
(H) menjadi (H2O). Gas karbon dioksida dapat dikenali berdasarkan
sifatnya yang mengeruhkan air kapur, sedangkan air dapat dikenali dengan kertas
kobalt dari biru menjadi merah muda (pink). (Aas Saidah dan Michael Purba, 2014 : 4)
Gambar 1.1 Bagan percobaan untuk menunjukkan karbon dan hidrogen dalam sampel organik. Karbon dan hidrogen akan teroksidasi menjadi karbon dioksida dan uap air. Terbentuknya karbon dioksida dikenali dengan air kapur, sedangkan air dikenali dengan kertas kobalt.
Amati video berikut ini !!!
Amati video berikut ini !!!
2.
Keunikan Atom Karbon
a. Karbon
mempunyai 4 elektron valensi
Sesuai
dengan nomor golonganya, karbon mempunyai 4 elektron valensi. Hal itu
menguntungkan karena untuk mencapai kestabilan, karbon dapat membentuk 4 ikatan
kovalen. Unsur dari golongan lain tidak dapat membentuk ikatan kovalen sebanyak
itu, kecuali jika melebihi oktet.
Gambar 1.2 berbagai senyawa karbon. Karbon yang mempunyai 4 elektron valensi dapat membentuk ikatan kovalen dengan berbagai jenis unsur.
Karbon
memiliki empat elektron terluar yang berikatan kovalen dengan atom karbon lain
membentuk rantai bercabang atau melingkar berbentuk cincin. Selain itu, atom
lain seperti oksigen, nitrogen, dan belerang dapat terikat pada atom karbon
melalui ikatan tunggal dan rangkap. Jadi, berbagai bentuk yang besar dapat
ditemukan, bahkan di antara molekul organik yang lebih kecil, seperti metanol. (Yayan Sunarya, 2011: 448)
b. Atom
karbon relatif kecil
Sesuai
dengan nomor periodenya, yaitu periode kedua, atom karbon hanya mempunyai 2
kulit atom sehingga jari-jari atom karbon relatif kecil. Hal ini menyumbang dua
keuntungan berikut. (Aas Saidah dan Michael Purba, 2014 : 6)
1)
Ikatan
kovalen yang dibentuk karbon relatif kuat.
2)
Karbon
dapat membentuk ikatan rangkap dua dan ikatan rangkap tiga
c. Atom
karbon dapat membentuk rantai karbon
Bagimana cara karbon
dapat membentuk banyak persenyawaan ? atom
karbon memiliki empat elektron valensi sehingga dapat membentuk ikatan
antaratom karbon berupa ikatan tunggal, ikatan rangkap dua, atau rangkap tiga.
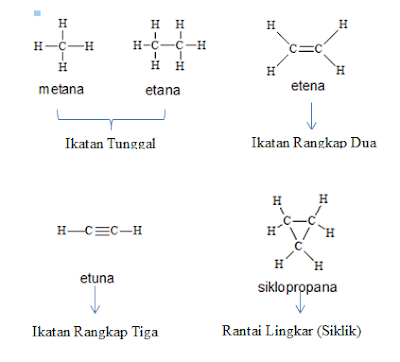
Selain itu, atom karbon dapat pula membentuk rantai lingkar (siklik). Hal
itulah menyebabkan mengapa jumlah senyawa karbon menjadi sangat banyak. (Aas Saidah dan Michael Purba, 2014 : 7)
Gambar 1.3 Berbagai macam bentuk ikatan dan bentuk rantai karbon dalam senyawa karbon.
Sifat unit atom karbon artinya, sifat yang memungkinkan keberadaan jutaan senyawa organik ialah kemampuannya untuk berbagi electron tidak saja dengan unsur yang berbeda tetapi juga dengan atom karbon lain. Misalnya, dua atom karbon dapat berikatan satu dengan yang lainnya, dan setiap atom karbon ini dapat berikatan dengan atom lain. Pada etana dan heksakloroetana, setiap karbon terhubung dengan karbon lain dan dengan tiga atom hidrogen atau tiga atom klorin. Meskipun senyawa ini memiliki dua atom karbon, bukan satu, kedua senyawa tersebut memiliki sifat-sifat kimia yang masing-masing mirip dengan sifat-sifat metana dan tetraklorometana. (Harold Hart dkk, 2003: 13)
Sifat unit atom karbon artinya, sifat yang memungkinkan keberadaan jutaan senyawa organik ialah kemampuannya untuk berbagi electron tidak saja dengan unsur yang berbeda tetapi juga dengan atom karbon lain. Misalnya, dua atom karbon dapat berikatan satu dengan yang lainnya, dan setiap atom karbon ini dapat berikatan dengan atom lain. Pada etana dan heksakloroetana, setiap karbon terhubung dengan karbon lain dan dengan tiga atom hidrogen atau tiga atom klorin. Meskipun senyawa ini memiliki dua atom karbon, bukan satu, kedua senyawa tersebut memiliki sifat-sifat kimia yang masing-masing mirip dengan sifat-sifat metana dan tetraklorometana. (Harold Hart dkk, 2003: 13)
3.
Jenis Atom Karbon
a.
Atom
C Primer
Atom
C primer adalah atom C yang hanya mengikat satu atom C lainnya. Pada senyawa hidrokarbon
jenuh, atom C peimer mengikat tiga taom H (-CH3)
b.
Atom
C Sekunder
Atom
C sekunder adalah atom C yang mengikat dua atom lainnya. Pada suatu senyawa
hidrokarbon jenuh, atom C sekunder mengikat dua atom H (-CH2-)
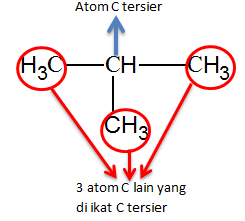
c. Atom
C Tersier
Atom
C tersier adalah atom C yang mengikat tiga atom C lainnya. Pada senyawa
hidrokarbon jenuh, atom C hanya mengikat satu atom H (-CH-)
d. Atom
C Kuartener
Atom
C kuartener adalah atom C yang mengikat empat atom C lainnya. Pada senyawa
hidrokarbon jenuh, atom C kuartener tidak mengikat atom H. (N Sutresna dan Astri Putri Perdana, 2014: 6-7)
Amati video berikut ini !!!










0 komentar:
Posting Komentar
masukan komentar anda